2025年8月7日���,c7c7.app曹濟民/周鑫團隊與清華大學基礎醫學院/北京生物結構前沿研究中心向燁課題組合作在《自然-通訊》(Nature Communications)雜志在線發表了題為“Structural insights into polymerase-catalyzed FAD capping of hepatitis C virus RNA”的研究論文�������。該研究利用X射線晶體學技術�����,揭示了丙型肝炎病毒(HCV)RNA 5′端合成FAD帽的分子機制���������,為HCV 防治提供了新的理論補充������。

丙型肝炎病毒(Hepatitis C virus, HCV)可引起急�������、慢性丙型肝炎������,以及肝細胞癌������。到目前為止�����,全世界有超過1.5億人感染HCV����,并且每年有300萬至400萬HCV 感染新發病例�������。多數HCV感染者早期無明顯癥狀����,但病毒會在幾乎沉默狀態下持續損害肝臟�������,并導致肝硬化����、肝癌等嚴重后果��。每年全球HCV相關死亡人數約50 萬��, HCV也被稱為“沉默殺手”��������。HCV是一種單股正鏈RNA病毒 (+RNA)���,屬于黃病毒科丙型肝炎病毒屬���。最近的一項研究表明六種不同基因型HCV的負鏈RNA(-RNA)5′末端存在FAD帽結構���,而特定基因型HCV的正鏈RNA(+RNA) 5′末端也存在FAD帽結構��������。FAD帽可幫助HCV RNA逃逸RIG-I介導的先天免疫識別���,這很可能是HCV隱匿感染的主要原因。
HCV基因組RNA的復制依賴于其編碼的非結構蛋白5B(NS5B)�������。NS5B與HCV +RNA的3′端結合�����,啟動互補鏈HCV -RNA的合成�������。合成的HCV -RNA隨后作為NS5B的模板�����,生成新的HCV +RNA����,從而實現病毒基因組的復制�����。HCV NS5B 可無需外源引物從頭合成其基因組RNA����。在體內NS5B啟動的從頭合成過程中�����,RNA模板以及啟動核苷酸和進入的核苷酸被容納在活性位點�����,合成初始二核苷酸引物���。隨后核苷酸的摻入會誘導NS5B發生構象變化��,使引發元件PE退出活性中心���������,并促使NS5B轉變為持續延伸狀態持續復制��������。在體外復制實驗中���,NS5B 可直接利用FAD而不能利用單個核苷酸啟動HCV RNA的合成。
本研究解析了HCV RNA聚合酶NS5B以FAD作為起始核苷酸從頭合成RNA(de novo initiation)����、引物引發(primed-initiation)以及延伸狀態下(elongation)的復合物結構���������。通過對這些復合物結構分析������,以及一系列生化研究證據��,表明引發元件PE的β loop中氨基酸殘基M447和Y448直接與FAD的核糖醇基團相互作用��,是NS5B起始階段特異性識別FAD的關鍵元素。此外���,FAD的腺嘌呤基團與HCV 基因組3′端的尿嘧啶形成堿基互補配對����,是其被添加在不同基因型負鏈RNA(-RNA)5′末端的決定因素����。進一步分析發現�����,在HCV RNA加FAD帽的延伸階段���,NS5B的C端linker中的W550與FAD的異咯嗪環相互作用���,穩定了5′端的FAD帽結構��������。這種相互作用進一步誘導了產物鏈的構象變化�����,形成了一種尚未被觀察到的�������、獨特的RNA雙鏈延伸中間態������,利于RNA雙鏈以不對稱的運動模式進行延伸(圖1)��������。本研究不僅為開發靶向HCV 的新型治療藥物提供了理論指導���,同時由于FAD非典型帽有幫助逃避宿主免疫的功能�����,這一性質也可能被應用于開發新型mRNA 修飾方法���������,助力mRNA疫苗及治療性藥物的發展�������。
該項工作由c7c7.app教授/c7c7.app-清華大學醫學院前沿醫學協同創新中心研究員王德平主導������,在清華大學團隊協助下完成。我校細胞生理學教育部重點實驗室曹濟民教授�������、周鑫教授和清華大學基礎醫學院/北京生物結構前沿研究中心向燁教授為該論文的通訊作者�����,我校細胞生理學教育部重點實驗室王德平教授和2019級直博生趙蓉為該論文的共同第一作者������。上海同步輻射光源和清華大學中國蛋白質科學中心(北京分中心)提供了設備支持���。該項目得到了c7c7.app-清華大學前沿醫學協同創新中心��、國家自然科學基金等的資助������。
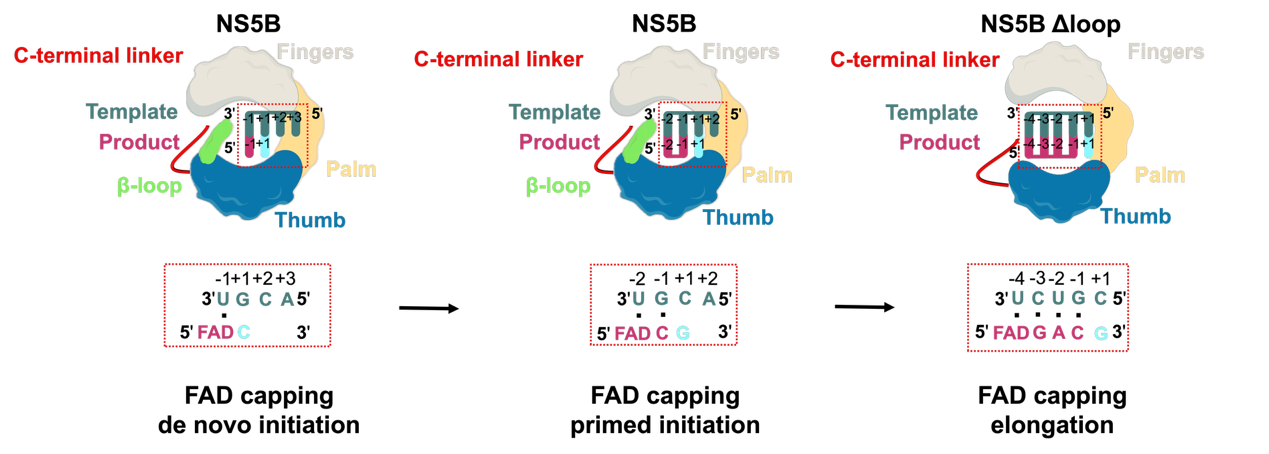
HCV的RNA聚合酶NS5B催化RNA 5′端加FAD帽的分子機制示意圖
初審初校�����:封啟龍
復審復校����:張 宇
終審終校����:王 卓

