公共衛生學院雷立健教授團隊揭示鎘致大鼠腎損傷模 型中 m 6A 修飾圖譜及可能參與通路
4 月 11 日����������,c7c7.app公共衛生學院雷立健教授課題 組在 Ecotoxicology and Environmental Safety 在線發表題 為 “ Integrated analysis of transcriptome-wide m 6A methylation in a Cd-induced kidney injury rat model” 的論文。

文章截圖
該研究基于人群研究發現的重金屬鎘(Cd)暴露致腎功能 損傷的基����。私沂撅傭隕鱸嗟畝咀饔沒��������,構建了鎘致腎 損傷大鼠模型�������,通過高通量測序及生物信息學分析,揭示了鎘 致大鼠腎損傷中 N6-甲基腺苷(m 6A)的修飾圖譜及該過程中可能涉及的通路和基因�������,認為 m 6A 修飾可能通過調控炎癥和代謝 相關通路參與氯化鎘誘導腎損傷過程������,從 m 6A 修飾角度為鎘致 腎損傷機制研究提供了新的思路�����。
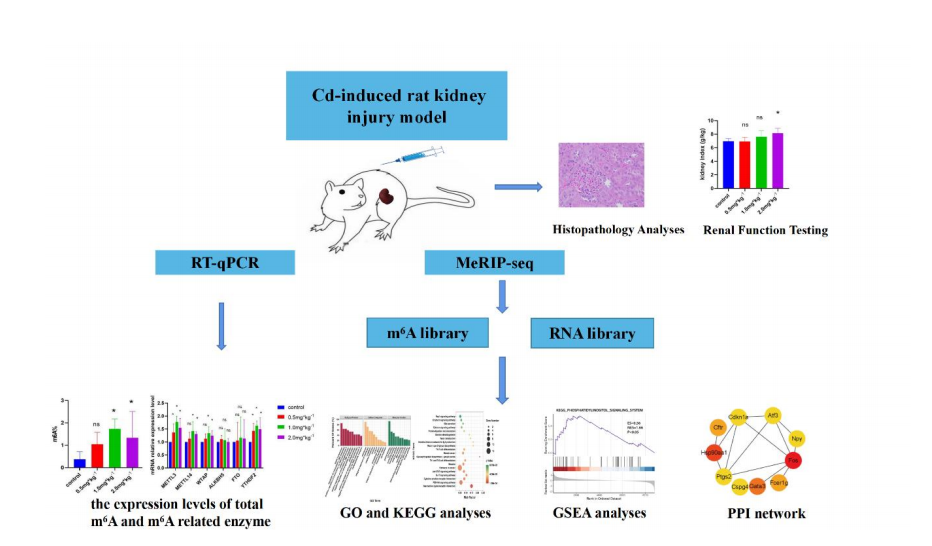
圖 1.圖形摘要
鎘(Cd)是一種有毒的重金屬����,被 WHO 國際癌癥研究機構 (IARC)確定為 I 類致癌物����,在環境中長期積累和持續存在��,對人體健康造成威脅����。腎臟作為 Cd 的主要蓄積器官極易受到 Cd 的毒性作用���������,Cd 可導致腎近端小管上皮細胞混濁和凋亡�������,腎小球腫脹�����、增生和腎間質炎癥等從而影響腎臟的正常功能 [1]���������。同時�������,越來越多的證據表明�����, m 6A 在腎臟相關疾病中發揮著重 要作用 [2, 3]�������。然而���������,m 6A 在 Cd 誘導的腎損傷中的具體功能尚不清楚������。
本研究采用皮下注射氯化鎘(0.5������、1.0���、2.0 mg/kg)的 方法構建了大鼠腎損傷模型�������。測定 m 6A 總體水平和 m 6A 修飾酶(METTL3�������、METTL14����、WTAP������、ALKBH5�����、FTO)的相對表達水平�����, 結果顯示 1.0 mg/kg 和 2.0mg/kg 處理組總 m 6A 水平顯著高于 對照組����,且與對照組相比����,各暴露組的 METTL3��������、METTL14���、WTAP 和 YTHDF2 均顯著上調(P > 0.05)����,見圖 2����������。
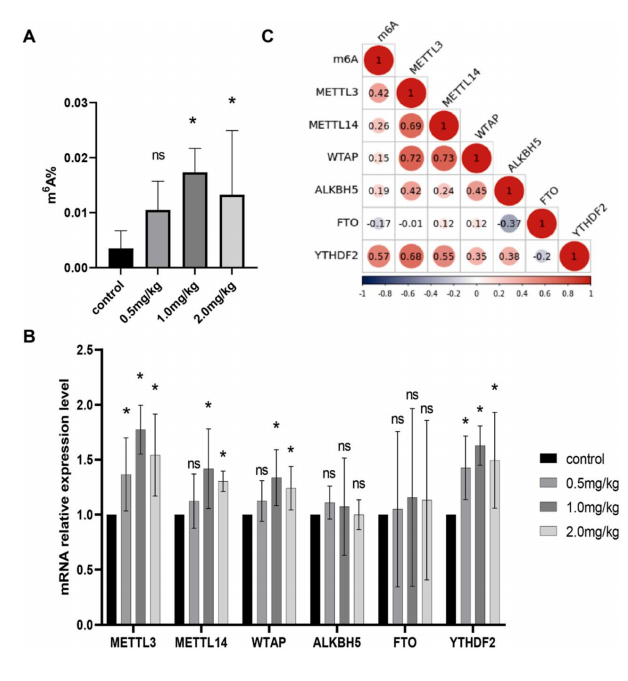
圖 2. CdCl2誘導的腎損傷模型中總 m6A 和 m6A 甲基化酶相對表達水平
通過甲基化RNA免疫共沉淀測序(MeRIP-seq)分析氯化鎘(2.0 mg/kg)處理組和對照組中轉錄組范圍內的 m6A 甲基化圖譜����������,見圖 3����。

圖 3. CdCl2處理組和對照組的 m 6A 甲基化圖譜概述
隨后���������,對測序數據進行 GO 和 KEGG 分析������,結果顯示����,在Cd 誘導的腎損傷中���,m 6A 修飾位點上調的基因可能調節炎癥反應����������,如 IL-17������、NOD 受體和 Notch 信號通路等炎癥相關通路���������。且利用基因集富集分析(GSEA)分析了測序基因的功能富集途徑��������,結果發現下調表達基因與脂肪酸代謝和不飽和脂肪酸的生 物合成有關�������。提示炎癥���、脂肪代謝相關通路可能參與Cd 誘導腎損傷過程���,見圖 4�������、圖 5�����。
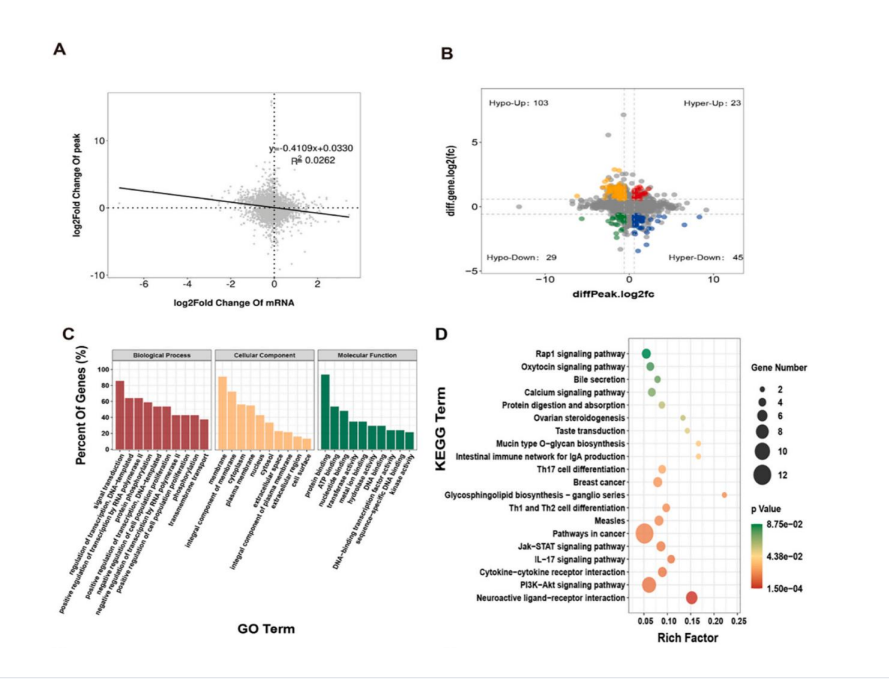
圖 4.聯合分析 CdCl2暴露組和對照組的 m 6A 甲基化和 mRNA 的表達
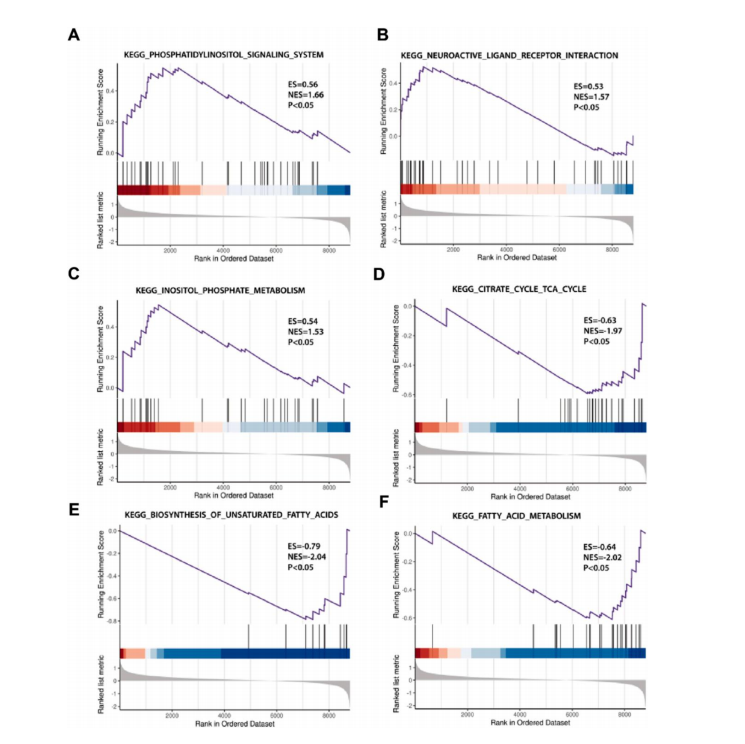
圖 5. GSEA 分析
此外��������,還構建了蛋白-蛋白相互作用(PPI)網絡并選擇了 10 個關鍵基因(Fos, Hsp90aa1, Gata3, Fcer1g, Cftr, Cspg4, Atf3, Cdkn1a, Ptgs2 和 Npy)��������,為進一步研究鎘致腎損傷可能 機制提供新思路�����,見圖 6。
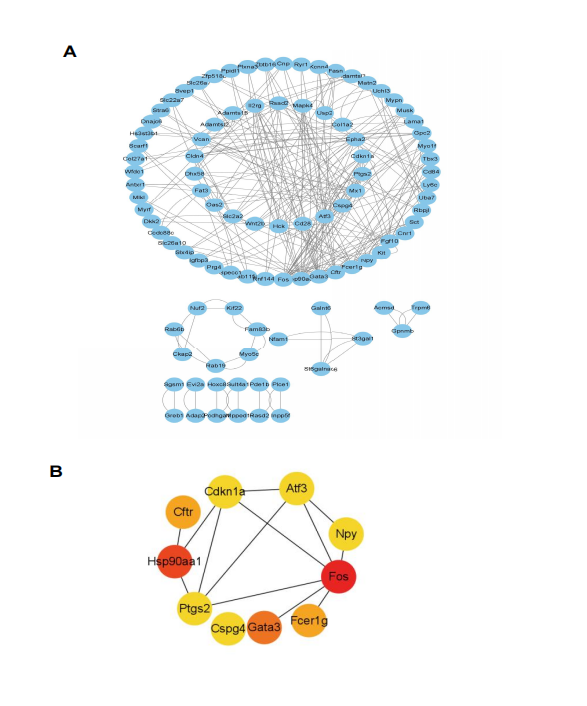
圖 6. PPI 互作網絡及關鍵基因
雷立健為本論文通訊作者���,c7c7.app公共衛生學院碩士研究生李雙婧���、周涵為該論文的共同第一作者�,山西醫科大學公共衛生學院碩士研究生梁宇芬��������、楊倩������、張佳晨�������、申煒垌參 與了部分工作�������。本研究得到國家自然科學基金和山西省回國留 學人員科研項目資助���。
參考文獻
1. Chou, X.L.J., Ma, K.P., Shen, Y., Sun, D.Y., Min, Z., 2021. The role of renal tubular epithelial cells in cadmium-induced renal fibrosis[J]. Chin. J. Ind. Hyg. Occup. Dis.39 (12), 903–909.
2. Xu, Y., Yuan, X.D., Wu, J.J., Chen, R.Y., Mou, S., 2020. The N6 – methyladenosine mRNAmethylase METTL14 promotes renal ischemic reperfusion injury via suppressing YAP1[J]. J. Cell Biochem. 121 (1), 524 –533.
3. Ning, Y., Chen, J., Shi, Y., Song, N., Yu, X., Fang, Y., Ding, X., 2020. Genistein ameliorates renal fibrosis through regulation snail via m 6A RNA demethylase ALKBH5[J]. Front. Pharmacol. 11, 579265.