基礎醫學院杜江鋒教授團隊與合作者《Advanced Functional Materials》發表研究成果:具有催化性能的鎢酸錳納米棒介導化學動力治療聯合放療治療三陰性乳腺癌
三陰性乳腺癌(TNBC)約占全部乳腺癌的15-20%���,由于其高侵襲性的生物學行為和精準治療靶點的缺乏,臨床現有治療手段治療效果不佳����,預后常較其他亞型的乳腺癌更差�����。因此�����,亟需針對三陰性乳腺癌的新的治療策略。

圖1 MWP合成示意圖和協同CDT/RT治療三陰性乳腺癌過程
2023年6月20日���,c7c7.app基礎醫學院/藥學院/第一臨床醫學院杜江鋒教授團隊與合作者發表的題為“Catalytic MnWO4 Nanorods for Chemodynamic Therapy Synergized Radiotherapy of Triple Negative Breast Cancer”的研究論文被《Advanced Functional Materials》(IF 19.92)雜志接收(EMID: a38ad786be4fd7a8)。該研究設計合成一種新型化學動力制劑和放療增敏劑——具有催化性能的鎢酸錳納米棒(MWP NRs)����,用于TNBC的協同化學動力學/放療(CDT/RT)治療����。MWP NRs中的Mn2+可在H2O2和HCO3-存在的條件下���,觸發腫瘤被動靶向的類芬頓效應���。此外,其順磁性也可用于癌癥影像學診斷����。另一方面�����,MWP NRs中存在高原子序數W(Z=74)����,可以增加腫瘤部位的X射線沉積進而增敏RT����。同時�����,RT也增加了輻照腫瘤中的H2O2水平���,提高了CDT的底物水平,從而促進了·OH的產生���。最終���,MWP NRs在CDT/RT協同作用下產生細胞凋亡并有效抑制了腫瘤(圖1)�����。
體外通過ESR和MB褪色反應驗證了MWP NRs在H2O2和HCO3-存在的條件下可產生類芬頓效應�����,且其催化效率與反應溫度、pH和MWP NRs濃度呈相關關系(圖2)�����。

圖2 MWP介導的類芬頓效應及其影響因素考察情況
細胞水平考察了X射線對4T1細胞H2O2水平的影響�����,結果如圖3所示���:經過X射線輻照后,4T1細胞上清液及細胞質中的H2O2水平發生變化����,并隨著輻射劑量的增加�����,H2O2水平出現了較為明顯的提升���。
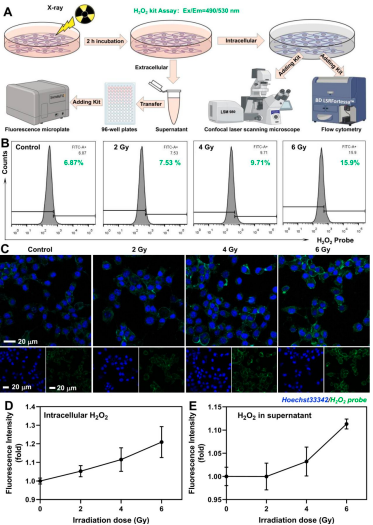
圖3 X射線提高4T1細胞H2O2水平情況檢測
為探究CDT/RT協同治療的潛在機制����,本研究通過激光共聚焦顯微成像�����、qPCR����、WB等方法,發現MWP NRs可能通過影響DNA雙鏈損傷修復過程(HR及NHEJ途徑)進而延緩DNA損傷修復���,最終將細胞周期調整至放療敏感的G2/M期���,產生有效的放療增敏效應���,增敏比可達1.45(圖4)���。

圖4 MWP NRs介導CDT/RT協同治療潛在機制
最后通過體內實驗考察MWP NRs介導的協同治療有效性,結果如圖5所示�����:CDT/RT聯合治療可有效抑制腫瘤的生長����,腫瘤抑制率高達80.4%。同時���,對分組治療后的腫瘤組織進行切片后可見���:聯合治療組具有更為稀疏的細胞核分布�����、低表達的Ki67和與之對應的高表達的cleaved Caspase 3和TUNEL水平�����。此外����,治療過程并未對小鼠體重造成明顯影響,表明MWP NRs具有良好的生物安全性。
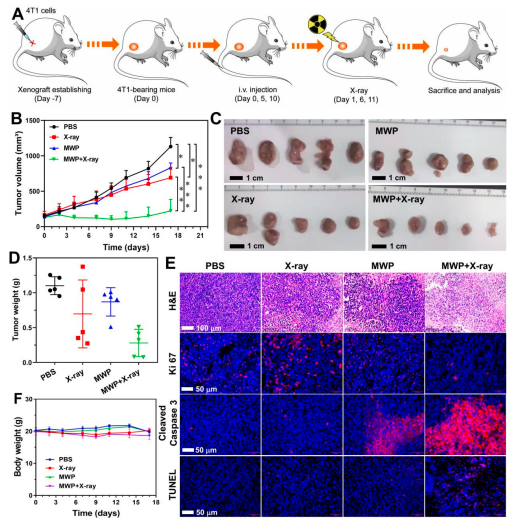
圖5 體內水平MWP NRs介導CDT/RT協同治療三陰性乳腺癌
MWP NRs作為一種新型化學動力學制劑和放療增敏劑首次被報道用于協同CDT/RT治療TNBC�����。MWP NRs介導的CDT/RT協同治療����,通過Mn觸發類芬頓反應擾亂細胞內氧化還原穩態�����,通過損害HR和NHEJ途徑延緩RT誘導的DSB修復�����,并將細胞周期調整至放射敏感的G2/M期;W元素介導放療增敏和輻照腫瘤部位H2O2水平提升以增敏CDT���,最終達到有效抑制三陰性乳腺癌的目的���。最重要的是�����,MWP NRs合成簡單�����、組分單一�����、可重復性強����,為其臨床轉化提供了堅實的基礎����。
這項研究的第一作者是c7c7.app基礎醫學院基礎醫學2020級碩士趙斌����,共同第一作者是c7c7.app藥學院2021級碩士馬智力�����。c7c7.app基礎醫學院/藥學院/第一臨床醫學院杜江鋒教授�����,中國人民解放軍陸軍軍醫大學第一附屬醫院/金鳳實驗室田甘教授����、張瀟教授為共同通訊作者����。該研究獲國家自然科學基金(81971747���,81901889�����,31900996)、重慶市自然科學基金(cstc2020jcyj-msxmX0061)����、西南醫院啟動經費(41CZDN)�����、山西省重點研發計劃(201903D121110)等項目資助。